DIFERENCIAS ENTRE COMITÉS DE ÉTICA EN INVESTIGACIÓN PÚBLICOS Y PRIVADOS
EN CIUDAD DE MÉXICO:
UN ESTUDIO CUALITATIVO
Fecha de recepción: 22-10-2010
Fecha de aceptación: 19-11-2010
Luz María Guadalupe Pichardo-García1
María de la Luz Casas-Martínez2
Lucy Reidl-Martínez3
Blanca López-Hernández1
1 Profesora asistente Escuela de Medicina, Universidad Panamericana, México. lpichard@up.edu.mx
2 Doctora en Bioética. Jefe del Departamento de Bioética de la
Escuela de Medicina, Universidad Panamericana, México.
3 Psicóloga. Docente Universidad Nacional Autónoma de México,
México.
4 Enfermera. Docente Escuela de Enfermería, Universidad Panamericana,
México.
RESUMEN
Objetivo. Describir problemas que enfrentan los Comités de Ética en Investigación (CEI) en la Ciudad de México. Método. Estudio cualitativo con muestreo intencional, grupos de discusión y teoría fundamentada con CEI de sector público y privado en instituciones de salud de la Ciudad de México. Resultados. Se detectaron importantes diferencias entre los CEI públicos y privados. Principalmente en carga de trabajo y prioridades de investigación. Los protocolos aprobados por CEI públicos son asumidos por la institución como un todo. Enfrentan cada caso como equipo de salud. Los CEI privados dirigen la responsabilidad de los protocolos al investigador principal que es quien la asume individualmente. Los CEI privados tienen una agenda centrada en los reportes de efectos adversos y la legalidad del proceso, mientras que los públicos en general se abocan además a la relevancia de la investigación para los pacientes. Ambos reciben pago por la revisión. Ambos coinciden en priorizar la ética de los protocolos en beneficio del paciente. Ambos están al tanto de que la industria farmacéutica les marca sus prioridades de investigación. Los CEI públicos abarcan principalmente investigación epidemiológica. Los CEI privados, esencialmente terapéutica.
PALABRAS CLAVE: comités de ética, ética médica, investigación, México. (Fuente: DeCS, Bireme).
_________________________________________________________________________________________________________
DIFFERENCES BETWEEN PUBLIC AND PRIVATE RESEARCH ETHICS
COMMITTEES IN MÉXICO CITY: A QUALITATIVE STUDY
ABSTRACT
Objective. Describe the problems facing research ethics committees (RECs) in Mexico City. Methodo. A qualitative study with purposivesampling, discussion groups and grounded theory focused on public and private sector RECs in health institutions in MexicoCity. Results. Significant differences were detected between public and private RECs, mainly with respect to their workload and re search priorities. The protocols approved by public RECs are assumed by the institution as whole. They address each case as health team. In contrast, the private RECs place accountability for the protocols on the chief researcher, who assumes that responsibility individually. The private RECs have an agenda focused on reports of adverse effects and the legality of the process, while the public RECs also generally afford consideration to the relevance of research for patients. Both are paid for the review. Both agree on prioritizing the ethics of protocols for the benefit of the patient. Both are aware the pharmaceutical industry has its research priorities. The public RECs deal mainly with epidemiological research, while the private RECs are concerned essentially with therapeutic research.
KEY WORDS: Ethics committees, ethics, medical, investigation, Mexico.
_________________________________________________________________________________________________________
RESUMO
Objetivo. Descrever os problemas enfrentados pelos Comitês de Ética em Pesquisa (CEI) na Cidade do México. Metodo. Estudo qualitativo com amostragem intencional, grupos focais e teoria fundamentada, realizado nos CEI dos setores público e privado em
instituições de saúde na Cidade do México. Resultados. Foram detectadas diferenças significativas entre os CEIs públicos e os
privados. Principalmente nas prioridades de trabalho e pesquisa. A instituição se encarrega dos protocolos aprovados pelos CEIs
públicos como um todo. Cada caso é estudado como equipe de saúde. Os CEIs privados delegam a responsabilidade dos protocolos
ao investigador principal, que os assume individualmente. Estes CEIs têm uma agenda baseada nos relatórios de efeitos adversos
e da legalidade do processo, enquanto os públicos procuram, ademais, a relevância da pesquisa para os pacientes. Ambos recebem
pagos pela revisão. Ambos concordam em priorizar a ética dos protocolos em benefício do paciente. Ambos estão conscientes de que a indústria farmacêutica determina as suas prioridades de pesquisa. Os CEIs públicos dedicam-se à investigação epidemiológica; os
privados, à terapêutica.
PALAVRAS-CHAVE: comissão de ética, ética médica, pesquisa, México.
________________________________________________________________________________________________________
INTRODUCCIÓN
Desde mediados del siglo XX hemos sido testigos del desarrollo acelerado de la investigación en salud (1). Estamos viviendo una auténtica revolución que ha sacudido los valores de la vida y los fines de la medicina, en especial, buscar curar (2). Hay nuevos paradigmas que están marcando la pauta en ámbitos tan cruciales como la salud, la enfermedad, la vida y la muerte. Surgen "nuevos derechos", a la par que se violan otros. Es una época de paradojas.
En este ámbito se encuentra la ética de la investigación. Se ha generado una creciente necesidad de medicamentos que impidan el dolor, prolonguen la vida, curen enfermedades antes mortales, y que al mismo tiempo tengan el mínimo de efectos secundarios indeseables. Los laboratorios farmacéuticos, convertidos en empresas, crecen económicamente con base en nuevas y más eficaces drogas. La industria farmacológica es actualmente un próspero negocio. La investigación terapéutica es el principal terreno en el que se mueven las decisiones éticas en la investigación (2), y constituye la orientación prioritaria de la experimentación biomédica actual. Otros estudios, como los epidemiológicos, se han limitado, en gran parte, al sector público y a estudios de institutos universitarios.
A la par de este desarrollo, aparece en 1970 una nueva y prometedora disciplina, denominada Bioética por van Rensselaer Potter, su gestor (3, 4). Este autor lanza unpuente al futuro, en sus propias palabras, sin medir el alcance que su neologismo traería, el cual ha tenido un desarrollo inesperado en los últimos cuarenta años.
Mientras Potter planteaba con la Bioética principalmente un desarrollo respetuoso de los ecosistemas, ahora se cuestiona y se plantea hasta dónde se debe respetar al ser humano, siendo una necesidad el protegerlo de los usos indebidos de la ciencia.
Numerosos casos se dieron en el siglo pasado de experimentaciones a costa de seres humanos inocentes. Baste citar: los abusos del nazismo, de donde surge el Código de Nüremberg de 1947, y el caso Tuskegee, en Estados Unidos, de donde surge el Informe Belmont de 1979 entre los más escalofriantes (5).
En la medicina se descubrieron, en 1966, 22 artículos fraudulentos en investigaciones biomédicas. Históricamente se ha comprobado la imperiosa necesidad de velar por la honestidad y rectitud del progreso científico y tecnológico, siempre dentro de un contexto ético
Es por ello que el desarrollo de los comités y las comisiones de ética está ligado a la historia de la Bioética en el mundo. A partir de los años setenta se da un paralelismo entre la aparición de comisiones que se dediquen a la ética de la investigación, y la consolidación de la Bioética y su difusión en todo el orbe.
Surge ahora el interés por estudiar los problemas que han enfrentado los Comités de Ética en Investigación (CEI) estos cuarenta años, en busca de luces que amplíen la visión actual. Los CEI en México han seguido un desarrollo paralelo al de los International Review Boards (IRB) en los Estados Unidos, influidos sobre todo por las normatividades y regulaciones establecidas por el gobierno norteamericano a través de la Food an Drug Administration (FDA), que ha marcado una fuerte pauta de referencia en toda Latinoamérica.
Este estudio busca analizar los problemas que los mismos comités han detectado para lograr una base ética en el avance científico y tecnológico. Su experiencia puede servir para enriquecer muchos aspectos de lo que se debe regular en cualquier experimentación.
MÉTODO
Diseño
Se aplicó un diseño no experimental, cualitativo-descriptivo, muestreo intencional (6,7), entrevistas individuales y grupos focales (GF) (8) para la obtención de datos y el análisis de la Teoría Fundamentada de Glaser y Strauss (9) a miembros de ocho CEI de Ciudad de México. Se manejaron tres variables para el diseño de los GF: Cargo en el CEI; tipo de institución, miembros médicos y no médicos.
Muestra
Se utilizó el muestreo intencionado o de conveniencia. Los criterios de inclusión fueron: contar con igual número de instituciones privadas y públicas. Se eligieron cinco públicas y cinco privadas. Se incluyeron las más pertinentes y accesibles, conforme al muestreo intencionado.
CEI con al menos tres años de funcionamiento.
Entrevistas
Los entrevistados hablaban de lo que querían sobre el tema. El entrevistador, en este caso, hacía la labor de centrar en los temas de interés, haciendo preguntas o comentarios pertinentes y tomando nota de los mismos. Se realizó la transcripción de cada entrevista. Utilizando el análisis de la teoría fundamentada se logró la saturación con 32 entrevistas. No hubo información que conformara una nueva categoría, distinta de las que se establecieron con la información de las entrevistas realizadas.
Se realizaron 32 entrevistas individuales semiestructuradas. El guión de la entrevista fue abierto, girando alrededor de ocho temas, a saber:
1. Perfil de los miembros.
2. Organización básica del CEI.
3. Revisión de protocolos.
4. Sesiones: dinámica.
5. Problemáticas que enfrentan.
6. Aspectos éticos claves por revisar.
7. Seguimiento de protocolos aprobados.
8. Puntos por mejorar en su CEI.
Grupos focales
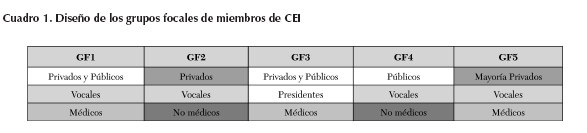
Se formaron cinco grupos focales con los miembros invitados de los diez CEI seleccionados progresivamente, a partir de una lista de hospitales elegidos por muestreo intencional. Se invitaron miembros de cinco CEI públicos y cinco privados, conforme al diseño. Aunque al final algunos asistentes cambiaron de fecha, no se modificaron las variables manejadas.
Los grupos focales fueron prediseñados de acuerdo con las tres variables mencionadas:
a. La profesión (médicos y enfermeras, y otras profesiones
no médicas).
b. La proveniencia de CEI públicos o privados.
c. El cargo o la función de los miembros en el CEI
(presidentes, secretarios y vocales: miembros y asesores
externos).
El criterio fue obtener grupos lo más homogéneos posibles, en los que se facilitara la confianza para hablar, sin la presión de la presencia de jefes o superiores, o diferencias de profesión, y se tuviera un nivel similar de formación profesional, asimismo diferencias entre CEI privados y públicos para obtener diferencias y semejanzas entre los grupos. Estos criterios se resumen en el Cuadro 1.
Se puso especial cuidado en respetar las normas de confidencialidad, anonimato y participación voluntaria de los comités participantes. Se manejaron códigos para cada institución y miembros respectivos. Se presentó una carta de invitación a los presidentes de los comités, en la cual se explicaron los objetivos del estudio y se solicitó la colaboración libre de los miembros para participar en los grupos focales.

En la carta se explicaban los objetivos del estudio y la metodología que se iba a seguir. Al inicio de cada sesión se les explicaron los objetivos del proyecto. El moderador (el investigador principal) condujo al grupo focal con base en un guión de tópicos de discusión previamente seleccionados. Un asistente se encargó de tomar notas de los comentarios y las actitudes relevantes. Se realizaron grabaciones de cada sesión, después de pedir su autorización a los asistentes. Las grabaciones fueron transcritas y cotejadas con los comentarios anotados. A cada participante se le asignó un número, en relación con su posición en la mesa, el grupo focal y su CEI de procedencia. La guía de discusión constaba de los puntos que se señalan en el Cuadro 2. No siempre se siguió un orden específico. Los temas fueron saliendo con espontaneidad. El moderador verificaba que se tocaran todos los puntos.
Codificación
Los datos colectados se fueron categorizando grupo por grupo. Cada codificación aportaba datos para mejorar el siguiente grupo de discusión. Toda la información se manejó por medio de claves para asegurar el anonimato y la confidencialidad. Se construyeron ocho categorías focales según la Teoría Fundamentada de Charmaz (2005), las cuales se utilizaron en el análisis de los resultados hasta alcanzar la saturación teórica, la cual se obtuvo con la codificación del quinto grupo. No hubo datos nuevos en el ámbito de búsqueda.
RESULTADOS
Entrevistas
Se realizaron 32 entrevistas individuales a los miembros de 10 CEI. Se fueron eligiendo las categorías más relevantes hasta alcanzar la saturación teórica de la teoría fundamentada. Enseguida se efectuó un análisis de los tópicos, contrastando con los planteados en los objetivos de los comités de ética en las Guías de la Unesco y planteados en los objetivos del estudio (10). Los resultados de los tópicos recurrentes del análisis de la teoría fundamentada, a partir de las entrevistas, se muestran en el Cuadro 3. Constituyen la parte principal de los resultados.

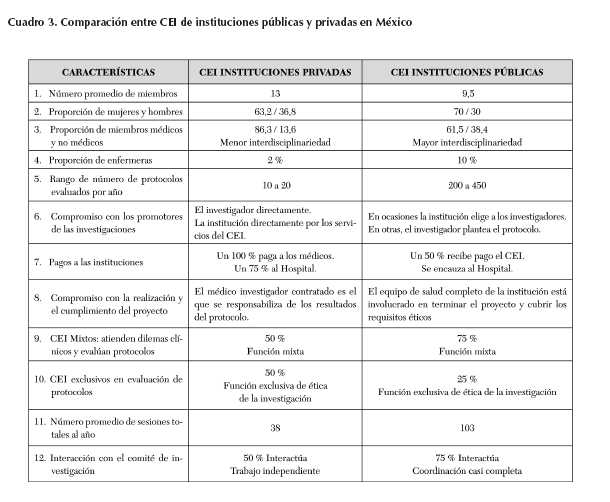
Es interesante notar cómo varía el perfil entre los CEI privados y los públicos. En ambos la mayoría son mujeres, en proporción de 7 a 3. Lo mismo las entrevistadas y las asistentes a GF son mayoría de 5 a 3. Esto nos puede indicar un mayor interés de la mujer en las investigaciones sobre cuestiones éticas y en la mejora de los CEI. En los privados la mayoría son médicos (87 por ciento), con la intención de mantenerse así, únicamente gente relacionada directamente con la investigación en salud, en una proporción de 87 a 13. No consideran relevante la interdisciplinariedad para la tarea de la ética de la investigación. Uno de sus comentarios literales apunta así: "los comités de ética deben ser integrados principalmente por médicos investigadores, con experiencia en metodología y enseñanza, y de preferencia que hayan trabajado en el sector público algunos años" (CEI008 Ent. 003).
Los médicos de comités públicos ven como perfil óptimo la profesión médica, con experiencia académica y en investigación, si no para todos los miembros sí para la mayoría. A diferencia de los públicos que siguen el modelo establecido por las guías de la Unesco (11), por lo que favorecen más la interdisciplinariedad. El CEI001 cuenta con ocho miembros de los cuales únicamente dos de ellos son médicos, el resto son trabajadora social, química, bióloga y enfermera.
El CEI001, comité de institución pública, tiene la mayor carga de trabajo y la mayor dedicación: reuniones semanales de dos horas de duración, un total de 100 horas de revisión de protocolos al año. Revisa alrededor de 400 trabajos en ese intervalo. Esta diferencia es marcadamente superior en los privados, que tienen un máximo de 20 protocolos al año. Esto puede ser debido a que la razón de ser de las instituciones públicas es la investigación (se manejaron institutos de salud gubernamentales). Los privados sólo captan la investigación a través de los médicos que están adscritos al Hospital. No funcionan como equipo de salud a cargo de un protocolo. Esto lo realiza el médico investigador de manera independiente. De ahí el reducido número de pacientes para reclutar y de protocolos por desarrollar. El médico privado es el único que hace tratos con la industria farmacéutica.
Es interesante señalar que los entrevistados reportan que los pagos por las revisiones son dirigidos directamente a las autoridades del hospital y se utilizan para mejoras en el comité (CEI005 y CEI007) o en la institución (CEI001 y CEI006). La mitad de los CEI se dedican exclusivamente a revisar protocolos, y tienen una buena coordinación con los comités de investigación. En un caso sesionan juntos, lo que disminuye en gran medida el tiempo de revisión. En este caso, es de un máximo de tres semanas. Los privados reportan que trabajan con independencia y falta de coordinación con los comités de investigación en el 50 por ciento de los casos.
Grupos focales
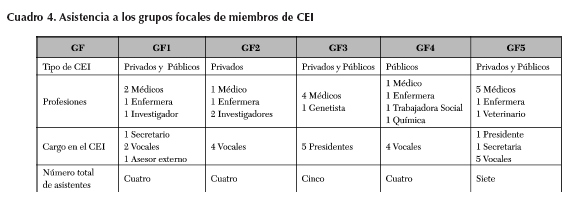
En los Grupos focales (GF) participan seis presidentes de comités, dos de ellos se desempeñan como coordinadores ejecutivos, tres secretarios, trece vocales y dos asesores externos. La asistencia a los grupos focales varió desde cuatro hasta siete participantes por grupo, que es lo óptimo en este tipo de entrevistas grupales.
Cada grupo focal tuvo una duración de mínimo una hora y cuarenta y siete minutos hasta un máximo de dos horas y media. La proporción mujeres /hombres en los grupos focales fue de 15:9. Y la de médicos y no médicos fue de 17:7. La asistencia por variables se resume en el Cuadro 4.
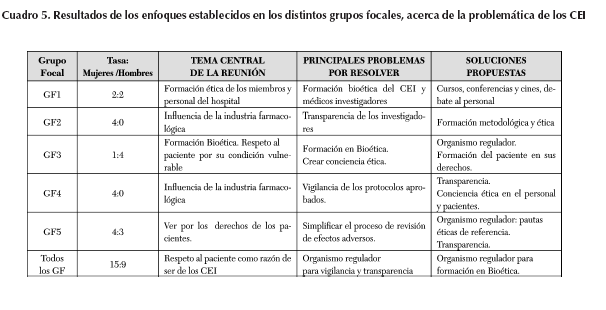
El tiempo de los miembros en el funcionamiento en los comités varió desde uno hasta 50 años de experiencia en el campo de la ética de la investigación. La mitad reconoció haber estado inicialmente en comités de instituciones públicas, lo cual proporcionó un plus de experiencia. Los comités seleccionados fueron fundados en un periodo de entre 3 y 19 años, con un promedio de 13 años, como comités de ética o bioética, asumiendo las funciones de evaluación de protocolos de investigación con participantes humanos. Los enfoques principales de los grupos se resumen en el Cuadro 5.
Reiterando lo obtenido en las entrevistas, en los GF se obtuvieron valores y tendencias muy similares, lo que corrobora y da robustez a los datos colectados. Los CEI públicos y privados fueron sustancialmente distintos en todo lo operativo. La carga de trabajo de los privados es 25 veces mayor a la de los públicos. El número de miembros también es mayor, llegando a un máximo de 17miembros contra 7 en los privados. El tiempo desde su fundación es mayor a 20 años en casi todos los públicos y en únicamente uno de los privados: el CEI008. El número de sesiones al mes son 4 y al año 50 en los públicos, mientras en los privados llegan a tener únicamente 6 sesiones al año. El tiempo promedio dedicado a cada sesión llega a ser de dos horas en los públicos y de una hora en los privados. El tipo de investigación que realizan los públicos es un 60 por ciento terapéutica, de parte de la industria, y un 40 por ciento epidemiológica, generada en la misma institución. En las instituciones privadas el 90 por ciento proviene de la industria farmacológica. Los datos se resumen en el Cuadro 6.
CONCLUSIONES
La realidad del sector salud de instituciones públicas es esencialmente distinta a la de los CEI privados. Los públicos cuentan con un mayor número de potenciales sujetos de investigación, la mayoría poblaciones cautivas y extremadamente vulnerables. Estos CEI revisan un promedio de 250 protocolos al año, un 60 por ciento de multi-céntricas y un 40 por ciento de producción propia, en la que se reclutan centenares de participantes de un nivel socioeconómico y cultural bajísimo, que todavía siguen un modelo paternalista extremo, donde el médico es la ley. Hay una total vulnerabilidad. No son conscientes de sus derechos elementales.
Los CEI privados, en cambio, atienden un promedio de 10 protocolos al año, casi todos de la industria farmacéutica (90 por ciento) y con un número muy reducido de sujetos participantes, que pertenecen a una clase social media o alta, con mayor nivel cultural y social, sujetos de posibilidades económicas que son más conscientes y capaces de defender sus derechos. La relación con el médico o la institución es más bien contractual. Atienden únicamente un 27 por ciento de la población.
En ambos casos, quien marca la pauta del tipo de investigación es la industria farmacéutica. Los privados están limitados a la experimentación terapéutica, a diferencia de los públicos, donde sólo un 60 por ciento sigue pautas de las farmacias, mientras que un 40 por ciento genera investigación asistencial y epidemiológica, más acorde a las necesidades de salud en el país.

Los públicos asumen los protocolos como equipo. Todos los profesionales de la salud quedan involucrados en el protocolo, por lo que es más sencillo el seguimiento, la vigilancia, la transparencia de resultados, y la protección del paciente. En los privados el seguimiento del paciente en el protocolo es responsabilidad exclusiva del médico investigador contactado por la industria. Nadie más se involucra o vigila. Todo se apuesta a la ética del médico contratado por la industria.
Todos los GF y entrevistados coinciden en la necesidad de conseguir una adecuada cultura bioética. Promotores, investigadores, miembros del CEI y pacientes sujetos de experimentación. Hay mucho por hacer.
El GF3 y el GF5 señalan la oportunidad de un organismo regulador supra-comités, que realice las necesarias labores de referencia, control y vigilancia, así como de intercambio de experiencias.
_______________________________________________________________________________________________________
REFERENCIAS 1. Ballesteros J, Fernández E. (cords). Biotecnología y Post-humanismo. España: Aranzadi; 2007. pp. 503. 2. Casas ML. Bases Bioéticas. Para la toma de decisiones en la práctica médica, investigación en humanos y trasplantes. México: Trillas; 2008. pp.13-15. 3. Potter VR. The science of survival, en Perspectives on Biology and Medicine. Bioethics 1970; (14): 120-153. 4. Potter VR. Bioethics: Bridge to the Future. England: Prentice- Hall, Englewood Cliffs; 1971. 5. Lavery JV, Grady Ch, Wahl ER, Emmanuel E. Ethical issues in International Bioemdical Research. A casebook. Oxford University Press; 2007. 6. Kerlinger F, HB Lee. Investigación del Comportamiento. Métodos de Investigación en Ciencias Sociales. 4 ed. México: McGraw Hill Interamericana; 2002. pp. 541-543. 7. Hernández R, Fernández C, Baptista P. Metodología de la investigación. 2 ed. México: McGraw Hill; 1991. pp. 184. 8. Krueger RA, Casey MA. Focus Groups. A practical Guide for applied Research. 4 ed. Los Angeles: Sage; 2009. pp. 219. 9. Charmaz K. Constructing Grounded Theory. A Practical Guide through Qualitative Analysis. London: SAGE Publications; 2006. pp. 208. 10. Guides World Health Organization. Surveying and Evaluating Ethical Review Practices. Operational Guidelines for ethical committees that review biomedical research. Geneva: 2002. 11. OMS. Guías para Comités de ética en Investigación. Génova; 2002. |